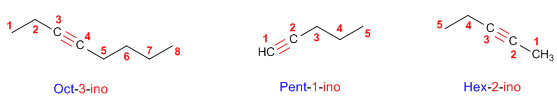
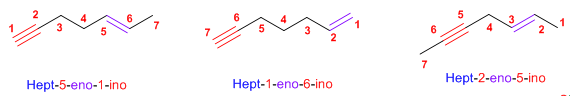
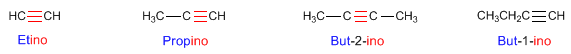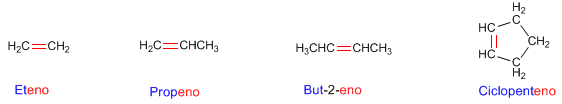Antecedentes:
Las
vitaminas pertenecen a uno de los grupos constituyentes de los alimentos que
provocan más controversias, debido al gran desconocimiento de su función. Las
vitaminas adquirieron importancia cuando se observó que la carencia de estas
sustancias en la dieta provocaba cuadros dramáticos. Enfermedades como el
raquitismo, beriberi, entre muchas.
Material
|
1
cuchara
|
3 vasos de
precipitados de 400 mL
|
|
1
agitador
|
1 Vaso de
precipitados de 600 mL
|
|
1 gotero
|
Soporte
universal completo
|
|
1 Mechero bunsen
|
Mortero con
pistilo.
|
Sustancias:
- VITAMINA C
- MANZANA
- ATÚN
- PAN
- PAN TOSTADO
- GALLETAS
- MANGO
1. Si
tu pastilla de vitamina C no es efervescente, colócala en el mortero y
tritúrala hasta hacerla polvo, después agrégala a un vaso de precipitados
conteniendo 100 ml de agua. Si tienes
pastilla efervescente, únicamente agrégala al vaso de precipitados con agua
2.
En otro vaso de precipitados, agrega la
disolución prueba preparada por tu profesor (agua con maicena y unas gotas de
yodo).
3.
Con el gotero, agrega una gota de la
disolución de vitamina C (vaso 1) en la disolución de prueba y agita. Continúa
agregando gotas hasta que ocurra un cambio.
4. Observa
el color de la disolución de prueba una vez que se agrega la disolución de la
vitamina C
5. Elimina
el contenido de todos los vasos, no ingiera ninguno, el Yodo es venenoso.
La
reacción que realizaste es típica del ácido ascórbico, por ello, permite su
identificación.
A continuación
trabajarás con la disolución prueba y los alimentos que hayas traído para
trabajar, empieza con los alimentos frescos, y después con los preparados o
enlatados.
Para
trabajar requerirás: si son frutas extraer un poco de jugo, si son verduras machacarlas
un poco con el mortero.
En el
caso, de los alimentos preparados, según sea el caso, requerirás agregar un
poco de agua para trabajar.